Müəllif:
Frank Hunt
Yaradılış Tarixi:
16 Mart 2021
YeniləMə Tarixi:
27 İyun 2024
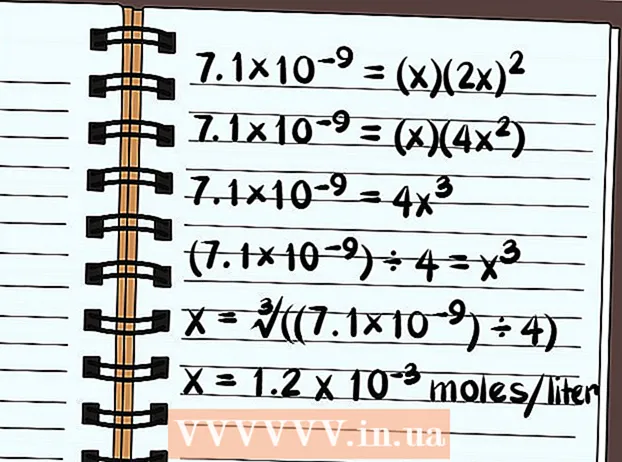
MəZmun
- Addımlamaq
- Metod 2-dən 1: Sürətli qaydalardan istifadə etmək
- Metod 2-dən 2: K-nin həll qabiliyyətinin hesablanması.sp
- Ehtiyaclar
- Göstərişlər
- Xəbərdarlıqlar
Kimyada çözünürlük, həll olunmamış hissəciklər qoymadan maye ilə qarışıq və tamamilə həll olan bir qatı maddənin xüsusiyyətlərini təsvir etmək üçün istifadə olunur. Yalnız (yüklü) ion birləşmələri həll olunur. Praktiki məqsədlər üçün bir neçə qaydanı əzbərləmək və ya bir qayda siyahısına müraciət etmək, ionlu birləşmələrin çoxunun su ilə qarışdırıldıqda möhkəm qalacağını və ya əhəmiyyətli bir miqdarın həll olunacağını söyləmək üçün kifayətdir. Əslində, bəzi molekullar heç bir dəyişiklik görməsəniz də həll olur, buna görə dəqiq təcrübələr üçün bu miqdarı necə hesablayacağınızı bilməlisiniz.
Addımlamaq
Metod 2-dən 1: Sürətli qaydalardan istifadə etmək
 İon birləşmələri haqqında daha çox məlumat əldə edin. Hər atomun normal olaraq bir sıra elektronu var, lakin bəzən bir əlavə elektron qazanır və ya itirir. Nəticə birdir ion elektrik yükü ilə. Mənfi yüklü bir ion (əlavə bir elektron) müsbət yüklü bir ionla qarşılaşdıqda (bir elektron çatışmır), iki maqnitin mənfi və müsbət uçları kimi bir-birinə bağlanırlar. Nəticə ion əlaqəsidir.
İon birləşmələri haqqında daha çox məlumat əldə edin. Hər atomun normal olaraq bir sıra elektronu var, lakin bəzən bir əlavə elektron qazanır və ya itirir. Nəticə birdir ion elektrik yükü ilə. Mənfi yüklü bir ion (əlavə bir elektron) müsbət yüklü bir ionla qarşılaşdıqda (bir elektron çatışmır), iki maqnitin mənfi və müsbət uçları kimi bir-birinə bağlanırlar. Nəticə ion əlaqəsidir. - Mənfi yüklü ionlara deyilir anionlarvə müsbət yüklü ionlar kationlar.
- Normalda atomdakı elektronların sayı, elektrik yüklərinin tarazlıqda olduğu protonların sayına bərabərdir.
 Həll qabiliyyətini bil. Su molekulları (H.2O) özlərini maqnit kimi apardıqları qeyri-adi bir quruluşa sahibdirlər: bir ucu müsbət yüklü, digəri ucu mənfi yüklənmişdir. Bir ion bağını su ilə qarışdırdığınız zaman, bu "su maqnitləri" ətrafa toplanaraq müsbət və mənfi ionları bir-birindən ayırmağa çalışacaqlar. Bəzi ion bağları bir-birinə çox sıx deyil; bunlar həll olunurçünki su əlaqəni qoparacaq və həll edəcəkdir. Digər kompozitlər daha güclü bağlara malikdir və var Həll edilə bilməzçünki su molekullarına baxmayaraq bir-birinə yapışa bilərlər.
Həll qabiliyyətini bil. Su molekulları (H.2O) özlərini maqnit kimi apardıqları qeyri-adi bir quruluşa sahibdirlər: bir ucu müsbət yüklü, digəri ucu mənfi yüklənmişdir. Bir ion bağını su ilə qarışdırdığınız zaman, bu "su maqnitləri" ətrafa toplanaraq müsbət və mənfi ionları bir-birindən ayırmağa çalışacaqlar. Bəzi ion bağları bir-birinə çox sıx deyil; bunlar həll olunurçünki su əlaqəni qoparacaq və həll edəcəkdir. Digər kompozitlər daha güclü bağlara malikdir və var Həll edilə bilməzçünki su molekullarına baxmayaraq bir-birinə yapışa bilərlər. - Bəzi əlaqələr, gücü ilə suyun çəkilməsi ilə müqayisə olunan daxili bağlara malikdir. Bu maddələr var orta dərəcədə həll olunur, çünki istiqrazların əhəmiyyətli bir hissəsi (hamısı deyil) ayrılacaqdır.
 Həll olunma qaydalarını öyrənin. Atomlar arasındakı qarşılıqlı təsirlər olduqca mürəkkəb olduğundan, hansı birləşmələrin həll və həll oluna biləcəyi həmişə asan deyil. Adətən necə davrandığını öyrənmək üçün aşağıdakı siyahıda birləşmədə ilk ionu tapın, sonra ikinci ionun qeyri-normal qarşılıqlı əlaqədə olmadığına əmin olmaq üçün istisnaları yoxlayın.
Həll olunma qaydalarını öyrənin. Atomlar arasındakı qarşılıqlı təsirlər olduqca mürəkkəb olduğundan, hansı birləşmələrin həll və həll oluna biləcəyi həmişə asan deyil. Adətən necə davrandığını öyrənmək üçün aşağıdakı siyahıda birləşmədə ilk ionu tapın, sonra ikinci ionun qeyri-normal qarşılıqlı əlaqədə olmadığına əmin olmaq üçün istisnaları yoxlayın. - Məsələn, stronsium xlorid (SrCl) istifadə etmək2), aşağıda göstərilən qalın addımlarla Sr və ya Cl axtarın. Cl "əsasən həll edilə bilən" dir, buna görə aşağıdakı istisnaları yoxlayın. Sr istisna olaraq göstərilmir, buna görə SrCl2 həll olun.
- Hər qaydanın ən ümumi istisnaları aşağıda verilmişdir. Digər istisnalar da var, amma yəqin ki, ümumi bir kimya dərsi və ya laboratoriyada tapa bilməzsiniz.
 Tərkiblər Li, Na, K, Rb və Cs daxil olmaqla qələvi metallar olduqda həll olur. Bunlara qrup IA elementləri də deyilir: lityum, sodyum, kalium, rubidium və sezyum. Bu ionlardan hər hansı biri ilə demək olar ki, hər hansı bir birləşmə həll olur.
Tərkiblər Li, Na, K, Rb və Cs daxil olmaqla qələvi metallar olduqda həll olur. Bunlara qrup IA elementləri də deyilir: lityum, sodyum, kalium, rubidium və sezyum. Bu ionlardan hər hansı biri ilə demək olar ki, hər hansı bir birləşmə həll olur. - İstisna: Li3PO4 həll olunmur.
 YOX ilə birləşir3, C2H.3O2, YOX2, ClO3 və ClO4 həll olunur. Bunlar sırasıyla nitrat, asetat, nitrit, xlorat və perklorat ionlarıdır. Asetatın tez-tez OAc ilə qısaldıldığını unutmayın.
YOX ilə birləşir3, C2H.3O2, YOX2, ClO3 və ClO4 həll olunur. Bunlar sırasıyla nitrat, asetat, nitrit, xlorat və perklorat ionlarıdır. Asetatın tez-tez OAc ilə qısaldıldığını unutmayın. - İstisnalar: Ag (OAc) (gümüş asetat) və Hg (OAc)2 (civə asetat) həll olunmur.
- AgNO2 və KClO4 yalnız "qismən həll olunur".
 Cl, Br və I ilə birləşmələr ümumiyyətlə həll olunur. Xlor, bromid və yodid ionları demək olar ki, həmişə halogen duzları kimi tanınan həll olunan birləşmələr əmələ gətirir.
Cl, Br və I ilə birləşmələr ümumiyyətlə həll olunur. Xlor, bromid və yodid ionları demək olar ki, həmişə halogen duzları kimi tanınan həll olunan birləşmələr əmələ gətirir. - İstisna: Bunlardan biri gümüş (Ag) ionları ilə birləşirsə, civə (Hg.)2) və ya qurğuşun (Pb), nəticə həll olunmur. Eyni, mis (Cu) və tallium (Tl) ilə daha az yayılmış birləşmələrə aiddir.
 SO ilə əlaqələr4 ümumiyyətlə həll olunur. Sülfat ionu ümumiyyətlə həll olunan birləşmələr əmələ gətirir, lakin bir neçə istisna var.
SO ilə əlaqələr4 ümumiyyətlə həll olunur. Sülfat ionu ümumiyyətlə həll olunan birləşmələr əmələ gətirir, lakin bir neçə istisna var. - İstisnalar: Sülfat ionu aşağıdakı ionlarla həll olunmayan birləşmələr əmələ gətirir: stronsium Sr, barium Ba, qurğuşun Pb, gümüş Ag, kalsium Ca, radium Ra və diatomik gümüş Ag2. Qeyd edək ki, gümüş sulfat və kalsium sulfat kifayət qədər həll olur ki, bəzən az həll olunur.
 OH və ya S ilə birləşmələr həll olunmur. Bunlar sırasıyla hidroksid və sulfid ionlarıdır.
OH və ya S ilə birləşmələr həll olunmur. Bunlar sırasıyla hidroksid və sulfid ionlarıdır. - İstisnalar: Qələvi metalları (Qrup I-A) və həll olunmayan birləşmələr yaratmağı nə qədər xoşladıqlarını xatırlayırsınız? Li, Na, K, Rb və Cs hamısı hidroksid və ya sulfid ionları ilə həll olunan birləşmələr əmələ gətirir. Bundan əlavə, hidroksid qələvi torpaq metalları (Qrup II-A) ionları ilə həll olunan duzlar əmələ gətirir: kalsium Ca, stronsium Sr və barium Ba. Diqqət yetirin ki, qələvi torpaq birləşməsi olan hidroksid bəzən "az həll olunan" hesab olunmaq üçün bir-birinə yapışacaq qədər kifayət qədər molekula malikdir.
 CO ilə birləşmələr3 və ya PO4 həll olunmur. Karbonat və fosfat ionları üçün son dəfə yoxlayın və birləşmədən nə gözlədiyini bilməlisiniz.
CO ilə birləşmələr3 və ya PO4 həll olunmur. Karbonat və fosfat ionları üçün son dəfə yoxlayın və birləşmədən nə gözlədiyini bilməlisiniz. - İstisnalar: Bu ionlar adi maddələrlə, Li, Na, K, Rb və Cs qələvi metalları ilə, eləcə də ammonium NH ilə həll olunan birləşmələr əmələ gətirir.4.
Metod 2-dən 2: K-nin həll qabiliyyətinin hesablanması.sp
 K sabitinin həll qabiliyyətinə baxın.sp. Bu sabit hər bir əlaqə üçün fərqlidir, buna görə dərslikdəki və ya onlayn bir cədvəldə axtarmağınız lazımdır. Bu dəyərlər təcrübə yolu ilə təyin olunduğundan, cədvəldən cədvələ çox fərqli ola bilər, buna görə də varsa, dərsliyinizdəki cədvəldən istifadə etmək yaxşıdır. Başqa bir şərt göstərilmədiyi təqdirdə, cədvəllərin əksəriyyəti ətraf mühitin temperaturu 25o C-dir.
K sabitinin həll qabiliyyətinə baxın.sp. Bu sabit hər bir əlaqə üçün fərqlidir, buna görə dərslikdəki və ya onlayn bir cədvəldə axtarmağınız lazımdır. Bu dəyərlər təcrübə yolu ilə təyin olunduğundan, cədvəldən cədvələ çox fərqli ola bilər, buna görə də varsa, dərsliyinizdəki cədvəldən istifadə etmək yaxşıdır. Başqa bir şərt göstərilmədiyi təqdirdə, cədvəllərin əksəriyyəti ətraf mühitin temperaturu 25o C-dir. - Məsələn, qurğuşun yodidini (PbI) həll etmək istəyirsinizsə2), çözünürlük məhsulunun tarazlıq sabitini yaz. Bilbo.chm.uri.edu-da bir cədvəl istifadə edirsinizsə, 7.1 × 10 sabitini istifadə edin.
 Əvvəlcə kimyəvi tənliyi yazın. Əvvəlcə birləşmənin həll olunduqda ionlara necə ayrıldığını müəyyənləşdirin. İndi K ilə bir tənlik yazın.sp bir tərəfdən, digər tərəfdən fərdi ionlar.
Əvvəlcə kimyəvi tənliyi yazın. Əvvəlcə birləşmənin həll olunduqda ionlara necə ayrıldığını müəyyənləşdirin. İndi K ilə bir tənlik yazın.sp bir tərəfdən, digər tərəfdən fərdi ionlar. - Məsələn, bir molekul PbI2 Pb, I və başqa I ionlarına bölünür (yalnız bir ionun yükünü bilməlisiniz və ya axtarmalısınız, çünki ümumi birləşmənin həmişə neytral yükə sahib olduğunu bilirsiniz).
- 7.1 × 10 = [Pb] [I] tənliyini yazın
 Dəyişənləri istifadə etmək üçün tənliyi tənzimləyin. Molekulların və ya ionların sayı barədə biliklərinizi istifadə edərək tənliyi tək bir cəbr problemi kimi yenidən yazın. Çıxacaq maddənin miqdarına x qoyun və dəyişənləri hər ionun sayı olaraq x olaraq yenidən yazın.
Dəyişənləri istifadə etmək üçün tənliyi tənzimləyin. Molekulların və ya ionların sayı barədə biliklərinizi istifadə edərək tənliyi tək bir cəbr problemi kimi yenidən yazın. Çıxacaq maddənin miqdarına x qoyun və dəyişənləri hər ionun sayı olaraq x olaraq yenidən yazın. - Nümunəmizdə 7.1 × 10 = [Pb] [I] yazırıq
- Mürəkkəbdə yalnız bir qurğuşun ionu (Pb) olduğundan, həll olunmuş qarışıq molekullarının sayı sərbəst qurğuşun ionlarının sayına bərabər olacaqdır. Beləliklə, [Pb] -ni x ilə əvəz edə bilərik.
- Hər qurğuşun ionu üçün iki yod ionu (I) olduğundan, yod atomlarının sayını 2x-ə bərabərləşdirə bilərik.
- İndi tənlik 7.1 × 10 = (x) (2x) oxuyur
 Varsa ümumi ionları nəzərdən keçirin. Tərkibi təmiz suda həll edirsinizsə bu addımı atlayın. Bununla birlikdə, birləşmə tərkibində bir və ya daha çoxunu təşkil edən ionlardan (bir "ümumi ion") olan bir həlldə həll olunarsa, həll qabiliyyəti əhəmiyyətli dərəcədə azalır. Ümumi ionların təsiri əsasən həll olunmayan birləşmələrdə daha çox nəzərə çarpır və bu hallarda tarazlıqda olan ionların böyük əksəriyyətinin məhlulda onsuz da mövcud olan iondan gəldiyini düşünmək olar. Onsuz da məhlulda olan ionların məlum molar konsentrasiyası (litrə görə mol və ya M) ilə bərabərliyi yenidən yazın, bu ion üçün istifadə etdiyiniz x dəyərini əvəz edin.
Varsa ümumi ionları nəzərdən keçirin. Tərkibi təmiz suda həll edirsinizsə bu addımı atlayın. Bununla birlikdə, birləşmə tərkibində bir və ya daha çoxunu təşkil edən ionlardan (bir "ümumi ion") olan bir həlldə həll olunarsa, həll qabiliyyəti əhəmiyyətli dərəcədə azalır. Ümumi ionların təsiri əsasən həll olunmayan birləşmələrdə daha çox nəzərə çarpır və bu hallarda tarazlıqda olan ionların böyük əksəriyyətinin məhlulda onsuz da mövcud olan iondan gəldiyini düşünmək olar. Onsuz da məhlulda olan ionların məlum molar konsentrasiyası (litrə görə mol və ya M) ilə bərabərliyi yenidən yazın, bu ion üçün istifadə etdiyiniz x dəyərini əvəz edin. - Məsələn, qurğuşun-yod qarışığımız 0,2 M qurğuşun xlor (PbCl) olan bir məhlulda həll edilmişdirsə2), sonra tənliyi 7.1 × 10 = (0.2M + x) (2x) olaraq yenidən yaza bilərik. Və sonra 0.2M x-dən daha yüksək bir konsentrasiya olduğundan, bunu 7.1 × 10 = (0.2M) (2x) olaraq etibarlı şəkildə yenidən yaza bilərik.
 Tənliyi həll edin. X üçün həll edin və birləşmənin necə həll olacağını bilin. Çözünürlük sabitinin təyin olunduğu üçün cavabınız, bir litr suya həll edilmiş birləşmənin mol sayı kimi ifadə ediləcəkdir. Son cavabı tapmaq üçün kalkulyatora ehtiyacınız ola bilər.
Tənliyi həll edin. X üçün həll edin və birləşmənin necə həll olacağını bilin. Çözünürlük sabitinin təyin olunduğu üçün cavabınız, bir litr suya həll edilmiş birləşmənin mol sayı kimi ifadə ediləcəkdir. Son cavabı tapmaq üçün kalkulyatora ehtiyacınız ola bilər. - Aşağıdakılar ümumi ionlarla deyil, təmiz suda çözünürlük üçün tətbiq olunur.
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7.1 × 10 = 4x
- (7.1 × 10) ÷ 4 = x
- x = ∛ ((7.1 × 10) ÷ 4)
- x = Litr başına 1,2 x 10 mol həll olacaq. Bu çox az bir miqdardır, buna görə də bu birləşmənin prinsipcə zəif həll olduğunu bilirsiniz.
Ehtiyaclar
- Çözünürlük məhsulları üçün sabitlər cədvəli (K.sp) əlaqələr üçün.
Göstərişlər
- Bir mürəkkəbin əridilmə dərəcəsi ilə bağlı təcrübələrdən əldə etdiyiniz məlumat varsa, həll qabiliyyəti sabitini həll etmək üçün eyni tənlikdən istifadə edə bilərsiniz.sp.
Xəbərdarlıqlar
- Bu terminlərin ümumdünya tərəfindən qəbul edilmiş bir tərifi yoxdur, lakin kimyaçılar birləşmələrin əksəriyyəti ilə razılaşırlar. Həll olunmuş və həll olunmamış molekulların əhəmiyyətli bir nisbətinə sahib birləşmələrə aid bəzi marjinal vəziyyətlər, fərqli həll cədvəlləri ilə təsvir edilə bilər.
- Bəzi köhnə dərsliklər NH verir4Yenidən həll olan bir kompozisiya olaraq OH. Bu səhvdir; az miqdarda NH4 və OH ionları müşahidə edilə bilər, ancaq bir birləşmə meydana gətirmək üçün təcrid edilə bilməz.