Müəllif:
Randy Alexander
Yaradılış Tarixi:
25 Aprel 2021
YeniləMə Tarixi:
26 İyun 2024
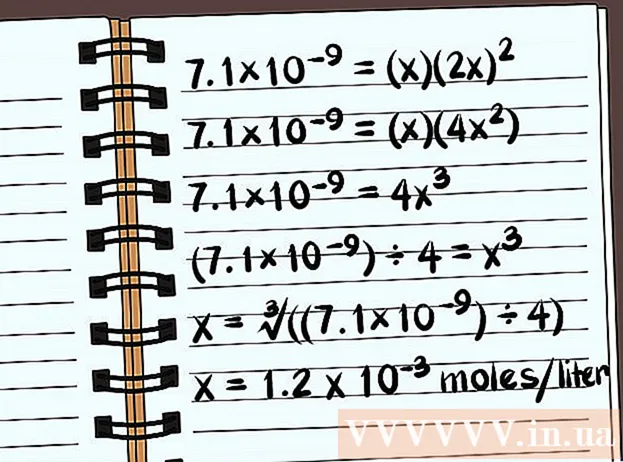
MəZmun
Kimyada həll olan qatı birləşmənin həll olunmayan bir qalıq qoymadan tamamilə bir mayedə həll edildiyi zaman xassələrini təsvir etmək üçün istifadə olunur. Yalnız ion birləşmələri həll olunur. Əslində, bir ion birləşmənin suya əlavə olunduqda qalıcı olub qalmayacağını və ya çox miqdarda həll olub olmadığını bilmək üçün yalnız bir neçə qayda əzbərləməlisiniz və ya ədəbiyyatı araşdırmalısınız. Əslində, heç bir dəyişiklik görməsəniz də, müəyyən bir molekul həll olur, bu səbəbdən təcrübənin dəqiq olması üçün bu miqdarda maddənin necə hesablanacağını bilməlisiniz.
Addımlar
Metod 2-dən 1: Sürətli qaydalardan istifadə edin
İon birləşmələri haqqında məlumat əldə edin. Hər atomda ümumiyyətlə müəyyən sayda elektron olur, lakin bəzən elektron alır və ya verir. Bu proses onu edir ionları ittiham olunur. Mənfi yüklü bir ion (bir elektrondan çox) müsbət yüklü bir ionla qarşılaşdıqda (bir elektron çatışmır), iki maqnitin katodu və anodu kimi bir-birinə bağlanacaqlar. Nəticə bir ion birləşməsi meydana gətirir.
- İonların mənfi bir yükü var anionlar, və ionlar müsbət yükə sahibdirlər kation.
- Normalda atomdakı elektron sayı proton sayına bərabərdir, bu səbəbdən heç bir yüklənmir.

Çözünürlüyü anlayın. Su molekulu (H2O) düzensiz bir quruluşa sahib olduğu üçün maqnitə bənzəyir: bir ucu müsbət, digəri isə mənfi yükə malikdir. İonik bir birləşməni suya qoyduğunuz zaman, bu su "maqnitləri" ətrafa toplaşaraq müsbət və mənfi ionları bir-birindən ayırmağa çalışırlar.- Bəzi ion birləşmələri çox sıx sorulmur, hesab olunur həll olunur Çünki suya əlavə olunduqda ayrılıb həll olacaqdır. Digər birləşmələr daha güclü əlaqələrə malikdir həll olunmaz çünki su molekulunun cazibəsindən asılı olmayaraq ionlar bir-birinə sıx şəkildə cəlb olunur.
- Bəzi birləşmələr bir su molekulunun cazibəsinə bərabər bir bağlama gücünə malikdir. Onlar hesab olunur az həll olunur çünki əksər birləşmələr ayrılacaq, amma qalanları yenə də bir-birinə çəkiləcəkdir.

Çökmə prinsipini anlayın. Atomlar arasındakı qarşılıqlı təsirlər çox mürəkkəb olduğundan, hansı birləşmələrin ola biləcəyini və edə bilməyəcəyini ayırd etmək üçün tamamilə intuisiyaya etibar edə bilməzsiniz. Ümumi xüsusiyyətləri üçün aşağıdakı siyahıdakı birləşmədə ilk ionu axtarın, sonra ikinci ionun onunla qeyri-adi qarşılıqlı təsir etməməsini təmin etmək üçün istisnaları yoxlayın.- Məsələn, stronsium xloru (SrCl) yoxlamaq üçün2), xahiş edirəm aşağıdakı qalın addımlarda Sr və ya Cl axtarın. Cl "ümumiyyətlə həll olunur", buna görə altındakı istisnaları yoxlayın. Sr istisna siyahısında deyil, buna görə SrCl2 həll olunmalıdır.
- Hər qaydanın ən ümumi istisnaları qaydanın altına yazılmışdır. Digər istisnalar da var, ancaq bunların normal kimya və ya laboratoriya saatlarında baş verməsi ehtimalı azdır.

Tərkiblər Li, Na, K, Rb və Cs kimi qələvi metallar olduqda həll olur. Bu metallar, qrup IA elementləri olaraq da bilinir: lityum, sodyum, kalium, rubidium və sezyum. Bu ionlardan birini ehtiva edən demək olar ki, bütün birləşmələr həll olunur.- İstisna: Li3PO4 həll olunmaz.
Birləşmələr YOXdur3, C2H3O2, YOX2, ClO3 və ClO4 hamısı həll olunur. Yuxarıda göstərilən ionlara uyğun adlar nitrat, asetat, nitrit, xlorat və perkloratdır. Asetatın tez-tez OAc kimi qısaldıldığını unutmayın.
- İstisna: Ag (OAc) (gümüş asetat) və Hg (OAc)2 (civə asetat) həll olunmur.
- AgNO2 və KClO4 yalnız "azca əriyib".
Cl, Br və I birləşmələri ümumiyyətlə həll olur. Xlor, bromid və yodid ionları demək olar ki, həmişə halogen duzları deyilən həll olunan birləşmələr əmələ gətirir.
- İstisna: Yuxarıda göstərilən ionlardan biri Ag, gümüş ionları ilə birləşirsə, civə Hg2və ya Pb qurğuşun, həll olunmayan birləşmələr meydana gətirəcəkdir. Eyni, mis Cu və thali Tl ilə birləşdikdə meydana gələn daha az yayılmış birləşmələr üçün də doğrudur.
SO tərkibli birləşmələr4 ümumiyyətlə həll olunur. Sülfat ionları tez-tez həll olunan birləşmələr meydana gətirir, lakin bir çox istisna var.
- İstisna: Sülfat ionları aşağıdakı ionlarla həll olunmayan bir birləşmə əmələ gətirir: stronsium Sr, barium Ba, qurğuşun Pb, gümüş Ag, kalsium Ca, radium Ra və Ag-nin gümüş atomları2. Diqqət yetirin ki, gümüş sulfat və kalsium sulfat yalnız orta dərəcədə həll olunur, buna görə bəziləri onları az həll oluna bilər.
OH və ya S olan maddələr həll olunmur. Bu ionların uyğun adları hidroksidlər və sulfidlərdir.
- İstisna: Qələvi metalları (I-A qrupları) və necə həll olunan birləşmələr yaratmağı xoşladıqlarını xatırlayırsınız? Li, Na, K, Rb və Cs hamısı hidroksid və ya sulfid ionları ilə həll olunan birləşmələr əmələ gətirir. Bundan əlavə, hidroksidlər qələvi torpaq metal ionları ilə həll olunan duzlar əmələ gətirir (Qrup II-A): kalsium Ca, stronsium Sr və barium Ba. Qeyd: hidroksidlər və qələvi torpaq metallarından hazırlanan birləşmələr əslində bir-birinə bağlı qalan çox sayda molekula malikdirlər, buna görə də bəzən "az həll olunan" hesab olunurlar.
CO tərkibli birləşmələr3 və ya PO4 həll olunmaz. Karbonat və fosfat ionları üçün son dəfə yoxlayın və birləşmənin həll olub olmadığını görəcəksiniz.
- İstisna: Bu ionlar Li, Na, K, Rb və Cs kimi qələvi metallarla və həmçinin ammonium ionu NH ilə həll olunan birləşmələr əmələ gətirir.4.
Metod 2-nin 2: Sabit K-dən həll olma qabiliyyətini hesablayınsp
Çözünürlük məhsulu sabitinə baxın Ksp. Bu sabit hər bir birləşmə üçün fərqlidir, buna görə onu dərslikdəki və ya onlayn bir qrafikdə axtarmalısınız. Bu dəyərlər eksperimental olaraq təyin olunduğundan və qrafiklər arasında əhəmiyyətli dərəcədə dəyişə bildiyindən, mövcud olduğu təqdirdə dərsliyin qrafikindən istifadə etmək yaxşıdır. Başqa bir göstərilmədiyi təqdirdə, əksər sahələr 25ºC bir sınaq temperaturu qəbul edirlər.
- Məsələn, deyək ki, PbI formulu ilə qurğuşun yodidini həll edirsiniz2, həll qabiliyyətini sabit yaz. Bilbo.chm.uri.edu saytındakı qrafaya müraciət edirsinizsə, onda 7,1 × 10 sabitini istifadə edirsiniz.
Kimyəvi tənlik yazın. Birincisi, həll edildikdə bu birləşmənin ion ayrılma qaydasını təyin edin. Sonra K ilə bərabərliyi yazınsp bir tərəfdə və digər tərəfdə komponent ionları.
- Məsələn, bir PbI molekulu2 Pb, I və I ionlarına ayrılır (yalnız bir ionun yükünü bilməlisiniz və ya yoxlamalısınız, çünki bütün birləşmələr həmişə elektrik baxımından neytraldır).
- 7,1 × 10 = tənliyini yazın
- Bu tənlik həll olma sabitidir, çözünürlük cədvəlində 2 ion tapa bilərsiniz. 2 l- ion olduğu üçün l- kvadrat olmalıdır.
Dəyişənləri istifadə etmək üçün tənlikləri dəyişdirin. Molekül və ionların sayı barədə bildiyiniz məlumatları istifadə edərək normal cəbri metodlardan istifadə edərək tənliyi yenidən yazın. Çökmək üçün birləşmənin kütləsinə bərabər x qoyun və x-nin hər ionun sayını təmsil etdiyi tənliyi yenidən yazın.
- Bu nümunədə 7,1 × 10 = tənliyini yenidən yazmalıyıq
- Qarışıqda yalnız bir qurğuşun ionu (Pb) olduğundan, həll olunan molekulların sayı sərbəst qurğuşun ionlarının sayına bərabərdir. Buna görə x olaraq təyin edə bilərik.
- Hər qurğuşun ionu üçün iki yod ionu (I) olduğundan, yod atomlarının sayını 2x-ə bərabər təyin edirik.
- İndi tənlik 7.1 × 10 = (x) (2x) olur
Varsa ümumi ionları nəzərə alın. Tərkibi distillə edilmiş suda həll edirsinizsə bu addımı atlayın. Bir mürəkkəb onsuz da bir və ya daha çox komponent ionuna ("ümumi ionlar") malik olan bir məhlulda həll olunarsa, birləşmənin həll qabiliyyəti xeyli azalacaqdır. Ümumi ionların təsiri, demək olar ki, həll olunmayan birləşmələrdə ən çox aşkar olacaq və bu vəziyyətdə tarazlıqda olan ionların çoxunun əvvəllər məhlulda olanları olduğunu düşünə bilərsiniz. Onsuz da məhlulda olan ionların molar konsentrasiyasını (litrə görə mol və ya M) hesablamaq üçün tənliyi yenidən yazın, bu dəyəri həmin ion üçün istifadə etdiyiniz dəyişən x ilə əvəz edin.
- Məsələn, qurğuşun yodid birləşməsi 0.2M qurğuşun xlorid (PbCl) həllində həll olunarsa2), tənliyi 7.1 × 10 = (0.2M + x) (2x) olaraq yenidən yazacağıq. 0.2M x-dən yüksək bir konsentrasiya olduğundan onu 7.1 × 10 = (0.2M) (2x) -ə yaza bilərik.
Tənliyi həll edin. X üçün həll edin və birləşmənin həll olacağını biləcəksiniz. Çözünürlük sabitinin tərifində cavabınızı bir litr suya həll olunan birləşmənin mol sayı baxımından yazmalısınız. Son cavabı tapmaq üçün kompüterinizi istifadə etməlisiniz.
- Aşağıdakı nümunə distillə edilmiş suda ümumi ionlar olmadan həll olma qabiliyyətidir.
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7.1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = Litrə 1,2 x 10 mol həll olacaq. Bu çox kiçik bir kütlədir, buna görə bu birləşmə demək olar ki, həll olunmur.
Nə lazımdır
- Mürəkkəbin çözünürlük məhsulu sabitlərinin cədvəli (Ksp)
Məsləhət
- Həll olunmuş birləşmələrin miqdarı ilə bağlı təcrübə məlumatlarınız varsa, həll olan sabit K üçün həll etmək üçün eyni tənlikdən istifadə edə bilərsiniz.sp.
Xəbərdarlıq
- Bu terminlərin tərifləri barədə bir fikir birliyi yoxdur, lakin kimyaçılar birləşmələrin əksəriyyəti ilə razılaşırlar. Həm həll oluna bilən, həm də həll olunmayan molekulların hər biri bu birləşmələrin fərqli bir təsviri olan əhəmiyyətli tərkib hissələrini təşkil etdiyi bir sıra xüsusi birləşmələr.
- Bəzi köhnə dərsliklərdə NH göstərilir4OH həll olunan bir qarışıqdır. Bu doğru deyil; Az miqdarda NH ionu təsbit edildi4 və OH, lakin bu iki ion birləşə bilməz.