Müəllif:
Mark Sanchez
Yaradılış Tarixi:
3 Yanvar 2021
YeniləMə Tarixi:
1 İyul 2024
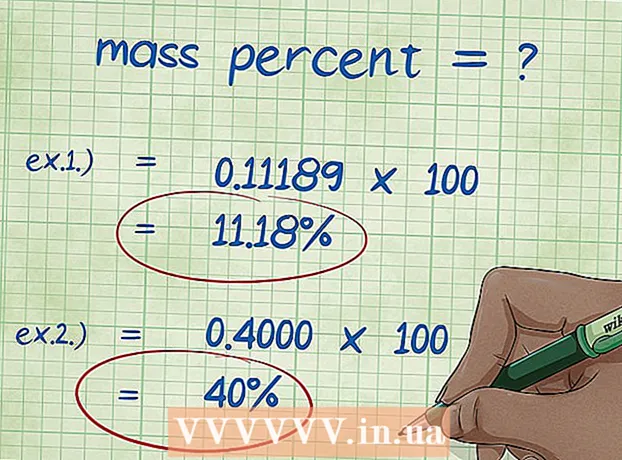
MəZmun
- Addımlar
- Metod 1 /2: Xüsusi çəkilərə əsaslanaraq kütləvi faizin təyin edilməsi
- Metod 2 /2: Kütlə göstərilmədikdə kütlə faizini təyin etmək
Kütlə faizi kimyəvi birləşmədə elementlərin faizini təyin edir. Kütlə faizini tapmaq üçün, tərkibə daxil olan elementlərin molar kütləsini (mol başına qramla) və ya müəyyən bir həll əldə etmək üçün lazım olan hər bir komponentin qram sayını bilməlisiniz.Kütlə faizi olduqca sadə hesablanır: elementin (və ya komponentin) kütləsini bütün birləşmənin (və ya məhlulun) kütləsinə bölmək kifayətdir.
Addımlar
Metod 1 /2: Xüsusi çəkilərə əsaslanaraq kütləvi faizin təyin edilməsi
 1 Kimyəvi birləşmənin çəki faizini təyin etmək üçün bir tənlik seçin. Kütlə faizi aşağıdakı düsturla hesablanır: kütlə faizi = (komponentin kütləsi / birləşmənin ümumi kütləsi) x 100. Yüzdə əldə etmək üçün bölgünün nəticəsi 100 -ə vurulur.
1 Kimyəvi birləşmənin çəki faizini təyin etmək üçün bir tənlik seçin. Kütlə faizi aşağıdakı düsturla hesablanır: kütlə faizi = (komponentin kütləsi / birləşmənin ümumi kütləsi) x 100. Yüzdə əldə etmək üçün bölgünün nəticəsi 100 -ə vurulur. - Problemi həll etməyin əvvəlində bərabərliyi yazın: kütlə faizi = (komponentin kütləsi / birləşmənin ümumi kütləsi) x 100.
- Maraqlandığınız komponentin kütləsi problemin vəziyyətində olmalıdır. Kütlə verilmədikdə, bilinməyən kütlə ilə kütlə faizini necə təyin edəcəyinizi izah edən növbəti hissəyə keçin.
- Bir kimyəvi birləşmənin ümumi kütləsi, bu birləşmənin (və ya məhlulun) bir hissəsi olan bütün elementlərin (komponentlərin) kütlələrini əlavə etməklə tapılır.
 2 Kompozisiyanın ümumi kütləsini hesablayın. Kompozisiyanı təşkil edən bütün komponentlərin kütlələrini bilirsinizsə, onları əlavə edin və bu yolla əldə edilən birləşmənin və ya məhlulun ümumi kütləsini tapacaqsınız. Kütlə faizi üçün tənliyinizdə məxrəc olaraq bu kütləni istifadə edirsiniz.
2 Kompozisiyanın ümumi kütləsini hesablayın. Kompozisiyanı təşkil edən bütün komponentlərin kütlələrini bilirsinizsə, onları əlavə edin və bu yolla əldə edilən birləşmənin və ya məhlulun ümumi kütləsini tapacaqsınız. Kütlə faizi üçün tənliyinizdə məxrəc olaraq bu kütləni istifadə edirsiniz. - Misal 1: 100 qram suda həll olunan 5 qram sodyum hidroksidin kütləvi faizi nədir?
- Solüsyonun ümumi kütləsi natrium hidroksid və su miqdarının cəminə bərabərdir: 100 g + 5 g 105 q verir.
- Misal 2: 175 qram 15 faizlik bir həll hazırlamaq üçün nə qədər sodyum xlorid və su lazımdır?
- Bu nümunədə ümumi kütlə və tələb olunan faiz verilir və məhlulun əlavə edilməsi lazım olan maddənin miqdarını tapmaq tələb olunur. Ümumi çəkisi 175 qramdır.
- Misal 1: 100 qram suda həll olunan 5 qram sodyum hidroksidin kütləvi faizi nədir?
 3 Göstərilən komponentin kütləsini təyin edin. "Kütlə faizini" hesablamaq istənirsə, maddənin ümumi kütləsinin neçə faizinin müəyyən bir komponentin kütləsi olduğunu öyrənməlisiniz. Göstərilən komponentin kütləsini qeyd edin. Kütlə faizi üçün düsturda hesablayıcı olacaq.
3 Göstərilən komponentin kütləsini təyin edin. "Kütlə faizini" hesablamaq istənirsə, maddənin ümumi kütləsinin neçə faizinin müəyyən bir komponentin kütləsi olduğunu öyrənməlisiniz. Göstərilən komponentin kütləsini qeyd edin. Kütlə faizi üçün düsturda hesablayıcı olacaq. - Misal 1: Verilmiş bir komponentin - natrium hidroxloridin kütləsi 5 qramdır.
- Misal 2: Bu nümunədə verilən komponentin kütləsi bilinmir və tapılmalıdır.
 4 Kütlə faiz tənliyinə dəyərləri daxil edin. Bütün lazımi dəyərləri təyin etdikdən sonra onları düstura daxil edin.
4 Kütlə faiz tənliyinə dəyərləri daxil edin. Bütün lazımi dəyərləri təyin etdikdən sonra onları düstura daxil edin. - Misal 1: kütlə faizi = (komponentin kütləsi / birləşmənin ümumi kütləsi) x 100 = (5 g / 105 g) x 100.
- Nümunə 2: kimyəvi komponentin bilinməyən kütləsini tapmaq üçün kütlə faizi formulunu çevirmək lazımdır: komponentin kütləsi = (kütlə faizi * birləşmənin ümumi kütləsi) / 100 = (15 * 175) / 100.
 5 Kütlə faizini hesablayın. Kütlə faizi üçün düsturdakı bütün dəyərləri əvəz etdikdən sonra lazımi hesablamaları aparın. Bir komponentin kütləsini kimyəvi birləşmənin və ya məhlulun ümumi çəkisinə bölün və 100 -ə vurun. Nəticə bu komponentin kütlə faizidir.
5 Kütlə faizini hesablayın. Kütlə faizi üçün düsturdakı bütün dəyərləri əvəz etdikdən sonra lazımi hesablamaları aparın. Bir komponentin kütləsini kimyəvi birləşmənin və ya məhlulun ümumi çəkisinə bölün və 100 -ə vurun. Nəticə bu komponentin kütlə faizidir. - Misal 1: (5/105) x 100 = 0.04761 x 100 = 4.761%. Beləliklə, 100 qram suda həll olunan 5 qram sodyum hidrokloridin çəkisi yüzdə 4,761 -dir.
- Nümunə 2: Bir komponentin kütləvi faizi üçün yenidən yazılmış ifadə (kütlə faizi * maddənin ümumi kütləsi) / 100 -dir, burada tapırıq: (15 * 175) / 100 = (2625) / 100 = 26.25 qram natrium xlorid.
- Solüsyonun ümumi kütləsindən komponentin kütləsini çıxarmaqla lazımi miqdarda su tapırıq: 175 - 26.25 = 148.75 qram su.
Metod 2 /2: Kütlə göstərilmədikdə kütlə faizini təyin etmək
 1 Kimyəvi birləşmənin ağırlıq faizi üçün bir düstur seçin. Kütlə faizini tapmaq üçün əsas tənlik aşağıdakı kimidir: kütlə faizi = (bir maddənin molar kütləsi / bir birləşmənin ümumi molekulyar kütləsi) x 100. Bir maddənin molar kütləsi müəyyən bir maddənin, molekulyar kütləsinin kütləsidir bütün kimyəvi birləşmələrin bir mol kütləsidir. Faizləri almaq üçün bölmə 100 ilə vurulur.
1 Kimyəvi birləşmənin ağırlıq faizi üçün bir düstur seçin. Kütlə faizini tapmaq üçün əsas tənlik aşağıdakı kimidir: kütlə faizi = (bir maddənin molar kütləsi / bir birləşmənin ümumi molekulyar kütləsi) x 100. Bir maddənin molar kütləsi müəyyən bir maddənin, molekulyar kütləsinin kütləsidir bütün kimyəvi birləşmələrin bir mol kütləsidir. Faizləri almaq üçün bölmə 100 ilə vurulur. - Problemi həll etməyin əvvəlində bərabərliyi yazın: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100.
- Hər iki miqdar mol başına qramla ölçülür (g / mol).
- Əgər sizə kütlələr verilmirsə, müəyyən bir maddədəki bir elementin kütləvi faizini molar kütlədən istifadə etməklə tapmaq olar.
- Misal 1: Su molekulundakı hidrogenin kütlə faizini tapın.
- Misal 2: Bir qlükoza molekulundakı karbonun kütlə faizini tapın.
 2 Kimyəvi formulu yazın. Əgər nümunə göstərilən maddələrin kimyəvi formullarını vermirsə, bunları özünüz yazmalısınız. Tapşırıqda kimyəvi maddələr üçün lazımi düsturlar varsa, bu addımı atıb birbaşa növbəti mərhələyə keçə bilərsiniz (hər bir elementin kütləsini tapın).
2 Kimyəvi formulu yazın. Əgər nümunə göstərilən maddələrin kimyəvi formullarını vermirsə, bunları özünüz yazmalısınız. Tapşırıqda kimyəvi maddələr üçün lazımi düsturlar varsa, bu addımı atıb birbaşa növbəti mərhələyə keçə bilərsiniz (hər bir elementin kütləsini tapın). - Misal 1: Suyun kimyəvi formulunu yazın, H2O.
- Misal 2: Qlükozanın kimyəvi formulunu yazın, C6H12O6.
 3 Kompozisiyadakı hər bir elementin kütləsini tapın. Periyodik cədvələ görə kimyəvi formuldakı hər bir elementin molar çəkisini təyin edin. Tipik olaraq, bir elementin kütləsi kimyəvi simvolu altında göstərilir. Sözügedən birləşməni təşkil edən bütün elementlərin molar kütlələrini yazın.
3 Kompozisiyadakı hər bir elementin kütləsini tapın. Periyodik cədvələ görə kimyəvi formuldakı hər bir elementin molar çəkisini təyin edin. Tipik olaraq, bir elementin kütləsi kimyəvi simvolu altında göstərilir. Sözügedən birləşməni təşkil edən bütün elementlərin molar kütlələrini yazın. - Misal 1: Oksigen (15.9994) və hidrogenin (1.0079) molar kütlələrini tapın.
- Misal 2: Karbon (12.0107), oksigen (15.9994) və hidrogenin (1.0079) molyar kütlələrini tapın.
 4 Hər bir elementin molar kütləsini molar hissəsinə vurun. Hər bir elementin neçə molunun müəyyən bir kimyəvi tərkibdə olduğunu, yəni elementlərin mol hissələrini təyin edin. Mole fraksiyaları, düsturdakı element simvollarının altındakı ədədlərlə verilir. Hər bir elementin molar kütləsini molar hissəsinə vurun.
4 Hər bir elementin molar kütləsini molar hissəsinə vurun. Hər bir elementin neçə molunun müəyyən bir kimyəvi tərkibdə olduğunu, yəni elementlərin mol hissələrini təyin edin. Mole fraksiyaları, düsturdakı element simvollarının altındakı ədədlərlə verilir. Hər bir elementin molar kütləsini molar hissəsinə vurun. - Misal 1: hidrogen simvolu altında 2, oksigen simvolu altında isə 1 (ədədin olmamasına bərabərdir). Beləliklə, hidrogenin molar kütləsi 2 ilə vurulmalıdır: 1.00794 X 2 = 2.01588; oksigenin molar kütləsini eyni olaraq buraxırıq, 15.9994 (yəni 1 -ə vurun).
- Misal 2: karbon simvolu altında 6, hidrogen 12 və oksigen 6 altındadır. Elementlərin molar kütlələrini bu ədədlərlə vuraraq tapırıq:
- karbon: (12.0107 * 6) = 72.0642
- hidrogen: (1.00794 * 12) = 12.09528
- oksigen: (15.9994 * 6) = 95.9964
 5 Kompozisiyanın ümumi kütləsini hesablayın. Bu tərkibə daxil olan bütün elementlərin tapılmış kütlələrini əlavə edin. Elementlərin molar kütlələrinin mol fraksiyaları ilə vurulması, kimyəvi birləşmənin ümumi kütləsini verəcəkdir. Bu rəqəm kütləvi faiz üçün düsturda bölücüdür.
5 Kompozisiyanın ümumi kütləsini hesablayın. Bu tərkibə daxil olan bütün elementlərin tapılmış kütlələrini əlavə edin. Elementlərin molar kütlələrinin mol fraksiyaları ilə vurulması, kimyəvi birləşmənin ümumi kütləsini verəcəkdir. Bu rəqəm kütləvi faiz üçün düsturda bölücüdür. - Misal 1: 2.01588 g / mol (iki mol hidrogen atomunun kütləsi) 15.9994 g / mol (bir mol oksigen atomunun kütləsi) əlavə edin, nəticə 18.01528 q / mol təşkil edir.
- Misal 2: Tapılan molar kütlələri əlavə edin: karbon + hidrogen + oksigen = 72.0642 + 12.09528 + 95.9964 = 180.156 q / mol.
 6 Maraqlanan elementin kütləsini təyin edin. "Kütlə faizini" tapmaq istənirsə, birləşmənin bir hissəsi olan müəyyən bir elementin kütləsini bütün elementlərin ümumi kütləsinin faizi olaraq hesablamalısınız. Verilmiş elementin kütləsini tapın və yazın. Bunun üçün elementin molar kütləsini onun molar hissəsinə vurmaq lazımdır. Nəticədə, kütləvi faiz üçün düsturun payında olan dəyəri alırsınız.
6 Maraqlanan elementin kütləsini təyin edin. "Kütlə faizini" tapmaq istənirsə, birləşmənin bir hissəsi olan müəyyən bir elementin kütləsini bütün elementlərin ümumi kütləsinin faizi olaraq hesablamalısınız. Verilmiş elementin kütləsini tapın və yazın. Bunun üçün elementin molar kütləsini onun molar hissəsinə vurmaq lazımdır. Nəticədə, kütləvi faiz üçün düsturun payında olan dəyəri alırsınız. - Misal 1: Birləşmədə hidrogen kütləsi 2.01588 g / mol (iki mol hidrogen atomunun kütləsi) dir.
- Misal 2: Qarışıqdakı karbon kütləsi 72.0642 g / mol (altı mol karbon atomunun kütləsi).
 7 Kütlə faiz tənliyinə ədədi dəyərlər qoyun. Bütün miqdarların dəyərlərini təyin etdikdən sonra onları ilk addımda verilən formula daxil edin: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100.
7 Kütlə faiz tənliyinə ədədi dəyərlər qoyun. Bütün miqdarların dəyərlərini təyin etdikdən sonra onları ilk addımda verilən formula daxil edin: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100. - Misal 1: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100 = (2.01588 / 18.01528) x 100.
- Misal 2: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100 = (72.0642 / 180.156) x 100.
 8 Kütlə faizini hesablayın. Ədədi dəyərləri əvəz etdikdən sonra, lazım olan arifmetik əməliyyatları yerinə yetirin.Elementin kütləsini birləşmənin ümumi kütləsinə bölün və 100 -ə vurun. Nəticədə elementin kütlə faizidir.
8 Kütlə faizini hesablayın. Ədədi dəyərləri əvəz etdikdən sonra, lazım olan arifmetik əməliyyatları yerinə yetirin.Elementin kütləsini birləşmənin ümumi kütləsinə bölün və 100 -ə vurun. Nəticədə elementin kütlə faizidir. - Misal 1: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100 = (2.01588 / 18.01528) x 100 = 0.111189 x 100 = 11.18%. Beləliklə, su molekulundakı hidrogen atomlarının kütləvi faizi 11,18%-dir.
- Misal 2: kütlə faizi = (elementin molar kütləsi / birləşmənin ümumi molekulyar kütləsi) x 100 = (72.0642 / 180.156) x 100 = 0.4000 x 100 = 40.00%. Beləliklə, qlükoza molekulundakı karbon atomlarının çəki faizi 40.00%-dir.



