MəZmun
- Addımlar
- Metod 1 /3: Elementlərin Dövri Cədvəlindən istifadə edərək Atom Kütləsinin Tapılması
- Metod 2 3: Tək Atomun Atom Kütləsinin Hesablanması
- Metod 3 -dən 3: Bir elementin nisbi atom kütləsinin (atom ağırlığının) hesablanması
- İpuçları
- Sənə nə lazımdır
Atom kütləsi bu və ya digər atomu və ya molekulu təşkil edən bütün protonların, neytronların və elektronların kütlələrinin cəmidir. Proton və neytronlarla müqayisədə elektron kütləsi çox kiçikdir, buna görə hesablamalarda nəzərə alınmır. Rəsmi baxımdan bu yanlış olsa da, bu termin tez -tez bir elementin bütün izotoplarının orta atom kütləsini ifadə etmək üçün istifadə olunur. Əslində, bu nisbi atom kütləsidir, buna da deyilir atom çəkisi element. Atom çəkisi, bir elementin təbii olaraq meydana gələn bütün izotoplarının atom kütlələrinin ortalamasıdır. Kimyaçılar işlərini yerinə yetirərkən bu iki növ atom kütləsini fərqləndirməlidirlər - səhv bir atom kütləsi dəyəri, məsələn, bir reaksiya məhsulunun məhsuldarlığı üçün yanlış bir nəticəyə səbəb ola bilər.
Addımlar
Metod 1 /3: Elementlərin Dövri Cədvəlindən istifadə edərək Atom Kütləsinin Tapılması
 1 Atom kütləsinin necə yazıldığını öyrənin. Atom kütləsi, yəni verilən atom və ya molekulun kütləsi standart SI vahidlərində - qram, kiloqram və s. Bununla birlikdə, bu vahidlərdə ifadə olunan atom kütlələri son dərəcə kiçik olduğundan, çox vaxt vahid atom kütlə vahidlərində və ya qısaldılmış amu ilə qeyd olunur. - atom kütlə vahidləri. Bir atom kütlə vahidi, standart karbon-12 izotopunun kütləsinin 1/12 hissəsinə bərabərdir.
1 Atom kütləsinin necə yazıldığını öyrənin. Atom kütləsi, yəni verilən atom və ya molekulun kütləsi standart SI vahidlərində - qram, kiloqram və s. Bununla birlikdə, bu vahidlərdə ifadə olunan atom kütlələri son dərəcə kiçik olduğundan, çox vaxt vahid atom kütlə vahidlərində və ya qısaldılmış amu ilə qeyd olunur. - atom kütlə vahidləri. Bir atom kütlə vahidi, standart karbon-12 izotopunun kütləsinin 1/12 hissəsinə bərabərdir. - Atom kütləsi vahidi kütləni xarakterizə edir müəyyən bir elementin bir molu qramdır... Bu dəyər praktik hesablamalarda çox faydalıdır, çünki müəyyən bir maddənin müəyyən sayda atom və ya molekul kütləsini asanlıqla mollara çevirmək üçün istifadə edilə bilər və əksinə.
 2 Dövri cədvəldə atom kütləsini tapın. Əksər standart dövri cədvəllər, hər bir elementin atom kütlələrini (atom ağırlıqlarını) ehtiva edir. Bir qayda olaraq, element ilə birlikdə hüceyrənin altındakı bir rəqəm olaraq, kimyəvi elementi ifadə edən hərflərin altında göstərilir. Bu ümumiyyətlə tam ədəd deyil, ondalık kəsrdir.
2 Dövri cədvəldə atom kütləsini tapın. Əksər standart dövri cədvəllər, hər bir elementin atom kütlələrini (atom ağırlıqlarını) ehtiva edir. Bir qayda olaraq, element ilə birlikdə hüceyrənin altındakı bir rəqəm olaraq, kimyəvi elementi ifadə edən hərflərin altında göstərilir. Bu ümumiyyətlə tam ədəd deyil, ondalık kəsrdir. - Diqqət yetirin ki, hər bir element üçün dövri cədvəldə verilən bütün nisbi atom kütlələri orta dəyərlər. Kimyəvi elementlər fərqlidir izotoplar - atom nüvəsindəki əlavə və ya əskik neytronlara görə fərqli kütlələrə malik kimyəvi növlər. Buna görə də, dövri cədvəldə sadalanan nisbi atom kütlələri müəyyən bir elementin atomları üçün ortalama olaraq istifadə edilə bilər, ancaq yox müəyyən bir elementin bir atomunun kütləsi kimi.
- Atomların və molekulların molar kütlələrini hesablamaq üçün dövri cədvəldə verilən nisbi atom kütlələri istifadə olunur. Amu ilə ifadə olunan atom kütlələri (dövri cədvəldə olduğu kimi) mahiyyətcə ölçüsüzdür. Ancaq sadəcə, atom kütləsini 1 q / mol vuraraq bir elementin faydalı xüsusiyyətini alırıq - bu elementin bir mol atomunun kütləsi (qramla).
 3 Unutmayın ki, dövri cədvəldə elementlərin orta atom kütlələri verilmişdir. Daha əvvəl qeyd edildiyi kimi, dövri cədvəldə hər bir element üçün göstərilən nisbi atom kütlələri, bir atomdakı bütün izotopların kütlələrinin ortalamasıdır. Bu orta bir çox praktik məqsəd üçün dəyərlidir: məsələn, bir neçə atomdan ibarət molekulların molar kütləsini hesablamaq üçün istifadə olunur. Fərdi atomlarla işləyərkən bu dəyər ümumiyyətlə kifayət etmir.
3 Unutmayın ki, dövri cədvəldə elementlərin orta atom kütlələri verilmişdir. Daha əvvəl qeyd edildiyi kimi, dövri cədvəldə hər bir element üçün göstərilən nisbi atom kütlələri, bir atomdakı bütün izotopların kütlələrinin ortalamasıdır. Bu orta bir çox praktik məqsəd üçün dəyərlidir: məsələn, bir neçə atomdan ibarət molekulların molar kütləsini hesablamaq üçün istifadə olunur. Fərdi atomlarla işləyərkən bu dəyər ümumiyyətlə kifayət etmir. - Orta atom kütləsi bir neçə izotop üçün ortalama dəyər olduğu üçün dövri cədvəldə göstərilən dəyər deyil dəqiq hər hansı bir atomun atom kütləsinin dəyəri.
- Ayrı -ayrı atomların atom kütlələri, tək bir atomdakı dəqiq proton və neytron sayı nəzərə alınmaqla hesablanmalıdır.
Metod 2 3: Tək Atomun Atom Kütləsinin Hesablanması
 1 Verilmiş bir elementin və ya onun izotopunun atom nömrəsini tapın. Atom nömrəsi, bir elementin atomlarında olan protonların sayıdır, heç dəyişmir. Məsələn, bütün hidrogen atomları və yalnız onların bir protonu var. Natriumun atom nömrəsi 11 -dir, çünki nüvəsində on bir proton var, nüvəsində isə səkkiz proton olduğu üçün oksigen atom sayı səkkizdir. İstənilən elementin atom nömrəsini Mendeleyevin dövri cədvəlində tapa bilərsiniz - demək olar ki, bütün standart versiyalarında bu rəqəm kimyəvi elementin hərfinin yuxarıda göstərilmişdir. Atom nömrəsi həmişə müsbət tam ədəddir.
1 Verilmiş bir elementin və ya onun izotopunun atom nömrəsini tapın. Atom nömrəsi, bir elementin atomlarında olan protonların sayıdır, heç dəyişmir. Məsələn, bütün hidrogen atomları və yalnız onların bir protonu var. Natriumun atom nömrəsi 11 -dir, çünki nüvəsində on bir proton var, nüvəsində isə səkkiz proton olduğu üçün oksigen atom sayı səkkizdir. İstənilən elementin atom nömrəsini Mendeleyevin dövri cədvəlində tapa bilərsiniz - demək olar ki, bütün standart versiyalarında bu rəqəm kimyəvi elementin hərfinin yuxarıda göstərilmişdir. Atom nömrəsi həmişə müsbət tam ədəddir. - Tutaq ki, bir karbon atomu ilə maraqlanırıq. Karbon atomlarında hər zaman altı proton var, buna görə də atom nömrəsinin 6 olduğunu bilirik. Bundan əlavə, dövri cədvəldə, hüceyrənin üst hissəsində karbon (C) olan "6" rəqəminin olduğunu göstərir. atom karbon sayının altı olduğunu.
- Unutmayın ki, bir elementin atom nömrəsi dövri cədvəldəki nisbi atom kütləsi ilə təkcə əlaqəli deyil. Xüsusilə masanın üst hissəsindəki elementlər üçün bir elementin atom kütləsinin atom nömrəsinin iki qatından çox olduğu görünə bilər, ancaq atom nömrəsini ikiyə vurmaqla hesablanmır.
 2 Nüvədəki neytronların sayını tapın. Eyni elementin fərqli atomları üçün neytronların sayı fərqli ola bilər. Eyni sayda protona malik eyni elementin iki atomu fərqli sayda neytrona malik olduqda, bu elementin fərqli izotoplarıdır.Heç vaxt dəyişməyən proton sayından fərqli olaraq, müəyyən bir elementin atomlarında olan neytronların sayı tez -tez dəyişə bilər, buna görə də bir elementin orta atom kütləsi iki bitişik tam ədəd arasında olan onluq kəsr olaraq yazılır.
2 Nüvədəki neytronların sayını tapın. Eyni elementin fərqli atomları üçün neytronların sayı fərqli ola bilər. Eyni sayda protona malik eyni elementin iki atomu fərqli sayda neytrona malik olduqda, bu elementin fərqli izotoplarıdır.Heç vaxt dəyişməyən proton sayından fərqli olaraq, müəyyən bir elementin atomlarında olan neytronların sayı tez -tez dəyişə bilər, buna görə də bir elementin orta atom kütləsi iki bitişik tam ədəd arasında olan onluq kəsr olaraq yazılır. - Neytronların sayı elementin izotopunun təyin edilməsi ilə müəyyən edilə bilər. Məsələn, karbon-14 təbii olaraq meydana gələn karbon-12 radioaktiv izotopudur. Çox vaxt izotop nömrəsi element simvolu qarşısında üst simvol nömrəsi olaraq göstərilir: C. İzotop sayından proton sayını çıxarmaqla neytronların sayı tapılır: 14 - 6 = 8 neytron.
- Tutaq ki, maraqlanan karbon atomunda altı neytron var (C). Bu elementin bütün atomlarının təxminən 99% -ni təşkil edən ən bol karbon izotopudur. Bununla birlikdə, karbon atomlarının təxminən 1% -ində 7 neytron var (C). Digər karbon atomları 7 -dən çox və ya 6 -dan az neytrona malikdir və çox az miqdarda mövcuddur.
 3 Proton və neytron sayını əlavə edin. Bu, verilən atomun atom kütləsi olacaq. Nüvəni əhatə edən elektronların sayına məhəl qoymayın - onların ümumi kütləsi son dərəcə kiçikdir, buna görə də praktiki olaraq hesablamalarınıza təsir etmir.
3 Proton və neytron sayını əlavə edin. Bu, verilən atomun atom kütləsi olacaq. Nüvəni əhatə edən elektronların sayına məhəl qoymayın - onların ümumi kütləsi son dərəcə kiçikdir, buna görə də praktiki olaraq hesablamalarınıza təsir etmir. - Karbon atomumuzda 6 proton + 6 neytron var = 12. Beləliklə, bu karbon atomunun atom kütləsi 12-dir. Əgər bu "karbon-13" izotopu olsaydı, 6 proton + 7 neytron = atom ağırlığı olduğunu bilərdik. 13.
- Əslində karbon-13-ün atom kütləsi 13.003355-dir və bu dəyər eksperimental olaraq təyin olunduğundan daha doğrudur.
- Atom kütləsi izotop sayına çox yaxındır. Hesablamaların rahatlığı üçün izotop sayının çox vaxt atom kütləsinə bərabər olduğu qəbul edilir. Atom kütləsinin eksperimental olaraq təyin etdiyi dəyərlər, elektronların çox az qatqısı səbəbindən izotop sayını bir qədər üstələyir.
Metod 3 -dən 3: Bir elementin nisbi atom kütləsinin (atom ağırlığının) hesablanması
 1 Nümunədə hansı izotopların olduğunu müəyyənləşdirin. Kimyaçılar tez -tez müəyyən bir nümunədəki izotopların nisbətini kütlə spektrometri adlı xüsusi bir cihazdan istifadə edərək təyin edirlər. Bununla birlikdə, təlim zamanı bu məlumatlar sizə elmi ədəbiyyatdan götürülmüş dəyərlər şəklində tapşırıqlar, nəzarət və sair şərtlərdə veriləcəkdir.
1 Nümunədə hansı izotopların olduğunu müəyyənləşdirin. Kimyaçılar tez -tez müəyyən bir nümunədəki izotopların nisbətini kütlə spektrometri adlı xüsusi bir cihazdan istifadə edərək təyin edirlər. Bununla birlikdə, təlim zamanı bu məlumatlar sizə elmi ədəbiyyatdan götürülmüş dəyərlər şəklində tapşırıqlar, nəzarət və sair şərtlərdə veriləcəkdir. - Bizim vəziyyətimizdə deyək ki, iki izotopla məşğuluq: karbon-12 və karbon-13.
 2 Nümunədə hər bir izotopun nisbi məzmununu təyin edin. Hər bir element üçün fərqli nisbətlərdə fərqli izotoplar meydana gəlir. Bu nisbətlər demək olar ki, həmişə faizlərlə ifadə olunur. Bəzi izotoplar çox yaygındır, digərləri isə çox nadirdir - bəzən aşkar etmək çox çətindir. Bu miqdar kütləvi spektrometriya ilə müəyyən edilə bilər və ya bir kitabda tapıla bilər.
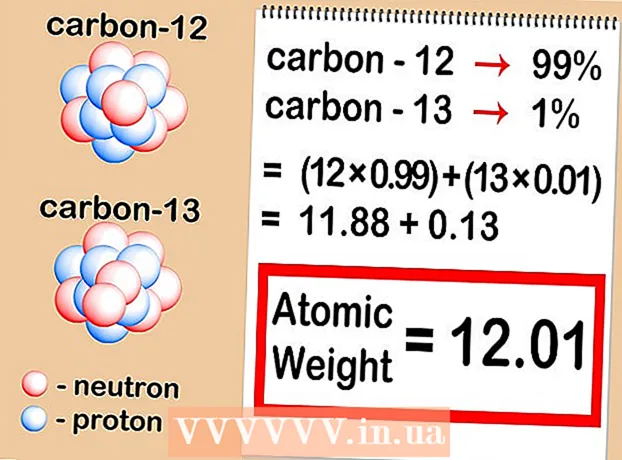
2 Nümunədə hər bir izotopun nisbi məzmununu təyin edin. Hər bir element üçün fərqli nisbətlərdə fərqli izotoplar meydana gəlir. Bu nisbətlər demək olar ki, həmişə faizlərlə ifadə olunur. Bəzi izotoplar çox yaygındır, digərləri isə çox nadirdir - bəzən aşkar etmək çox çətindir. Bu miqdar kütləvi spektrometriya ilə müəyyən edilə bilər və ya bir kitabda tapıla bilər. - Tutaq ki, karbon-12 konsentrasiyası 99%, karbon-13 isə 1%-dir. Digər karbon izotopları həqiqətən mövcuddur, lakin o qədər kiçik miqdarda ki, bu halda onlara laqeyd yanaşmaq olar.
 3 Hər bir izotopun atom kütləsini nümunədəki konsentrasiyasına vurun. Hər bir izotopun atom kütləsini onun faizinə vurun (ondalık hissə ilə ifadə olunur). Yüzdəlikləri ondalıklara çevirmək üçün sadəcə 100 -ə bölün. Yaranan konsentrasiyalar həmişə 1 -ə qədər artmalıdır.
3 Hər bir izotopun atom kütləsini nümunədəki konsentrasiyasına vurun. Hər bir izotopun atom kütləsini onun faizinə vurun (ondalık hissə ilə ifadə olunur). Yüzdəlikləri ondalıklara çevirmək üçün sadəcə 100 -ə bölün. Yaranan konsentrasiyalar həmişə 1 -ə qədər artmalıdır. - Nümunəmizdə karbon-12 və karbon-13 var. Əgər karbon-12 nümunənin 99% -i, karbon-13 isə 1% -dirsə, onda 12-ni (karbon-12-nin atom kütləsi) 0,99-a və 13-ə (karbon-13 atom kütləsi) 0,01-ə vurmaq lazımdır.
- İstinad kitabları, bir elementin bütün izotoplarının bilinən miqdarına əsaslanaraq faizlər verir. Kimya dərsliklərinin əksəriyyəti bu məlumatları kitabın sonunda cədvəl şəklində ehtiva edir. Araşdırılan nümunə üçün izotopların nisbi konsentrasiyaları da kütlə spektrometrindən istifadə etməklə təyin edilə bilər.
 4 Nəticələri əlavə edin. Əvvəlki addımda əldə etdiyiniz vurma nəticələrini ümumiləşdirin.Bu əməliyyat nəticəsində elementinizin nisbi atom kütləsini - sözügedən elementin izotoplarının atom kütlələrinin orta dəyərini tapa bilərsiniz. Bir elementin müəyyən bir izotopu deyil, bütövlükdə nəzərdən keçirilərkən istifadə olunan dəyərdir.
4 Nəticələri əlavə edin. Əvvəlki addımda əldə etdiyiniz vurma nəticələrini ümumiləşdirin.Bu əməliyyat nəticəsində elementinizin nisbi atom kütləsini - sözügedən elementin izotoplarının atom kütlələrinin orta dəyərini tapa bilərsiniz. Bir elementin müəyyən bir izotopu deyil, bütövlükdə nəzərdən keçirilərkən istifadə olunan dəyərdir. - Misalımızda, karbon-12 üçün 12 x 0.99 = 11.88, karbon-13 üçün 13 x 0.01 = 0.13. Bizim vəziyyətimizdə nisbi atom kütləsi 11.88 + 0.13 = 12,01.
İpuçları
- Bəzi izotoplar digərlərinə nisbətən daha az sabitdir: nüvədə daha az proton və neytron olan elementlərin atomlarına parçalanaraq atom nüvəsini təşkil edən hissəciklər buraxırlar. Belə izotoplara radioaktiv deyilir.
Sənə nə lazımdır
- Kimya kitabçası
- Kalkulyator