Müəllif:
Virginia Floyd
Yaradılış Tarixi:
6 Avqust 2021
YeniləMə Tarixi:
1 İyul 2024
MəZmun
- Addımlar
- Metod 1 /3: Əsaslar
- Metod 2 /3: Elektronqativliyə görə bağ növünün təyin edilməsi
- Metod 3 /3: Mulliken Elektroneqativliyinin Hesablanması
- İpuçları
Kimyada elektronegativlik, atomların digər atomlardan olan elektronları özünə cəlb etmək qabiliyyətidir. Yüksək elektronegativliyə malik bir atom elektronları güclü şəkildə cəlb edir, aşağı elektrotiklik qabiliyyətli bir atom isə elektronları zəif cəlb edir. Kimyəvi birləşmələrdə müxtəlif atomların davranışını proqnozlaşdırmaq üçün elektronegativlik dəyərləri istifadə olunur.
Addımlar
Metod 1 /3: Əsaslar
 1 Kimyəvi bağlar. Bu cür bağlar, atomlardakı elektronlar bir -biri ilə qarşılıqlı əlaqədə olduqda meydana gəlir, yəni iki elektron (hər atomdan bir) ortaqlaşır.
1 Kimyəvi bağlar. Bu cür bağlar, atomlardakı elektronlar bir -biri ilə qarşılıqlı əlaqədə olduqda meydana gəlir, yəni iki elektron (hər atomdan bir) ortaqlaşır. - Atomlarda elektronların qarşılıqlı təsirinin səbəblərinin təsviri bu məqalənin çərçivəsindən kənardır.Bu mövzuda daha çox məlumat üçün bu məqaləni oxuyun.
 2 Elektronegativliyin təsiri. İki atom bir -birinin elektronunu çəkəndə, cazibə qüvvəsi eyni deyil. Daha yüksək elektronegativliyə malik bir atom, iki elektronu daha güclü şəkildə cəlb edir. Çox yüksək elektrotexnikliyə malik bir atom, elektronları elə bir qüvvə ilə cəlb edir ki, artıq ortaq elektronlardan danışmırıq.
2 Elektronegativliyin təsiri. İki atom bir -birinin elektronunu çəkəndə, cazibə qüvvəsi eyni deyil. Daha yüksək elektronegativliyə malik bir atom, iki elektronu daha güclü şəkildə cəlb edir. Çox yüksək elektrotexnikliyə malik bir atom, elektronları elə bir qüvvə ilə cəlb edir ki, artıq ortaq elektronlardan danışmırıq. - Məsələn, NaCl molekulunda (natrium xlorid, adi duz), xlor atomu kifayət qədər yüksək elektronegativliyə malikdir və natrium atomu olduqca aşağıdır. Yəni elektronlar xlor atomuna cəlb olunur və natrium atomlarını itələyin.
 3 Elektronatiklik cədvəli. Bu cədvələ dövri cədvəldə olduğu kimi düzülmüş kimyəvi elementlər daxildir, lakin hər bir element üçün atomlarının elektronegativliyi verilmişdir. Belə bir cədvələ kimya dərsliklərində, istinad materiallarında və internetdə rast gəlmək olar.
3 Elektronatiklik cədvəli. Bu cədvələ dövri cədvəldə olduğu kimi düzülmüş kimyəvi elementlər daxildir, lakin hər bir element üçün atomlarının elektronegativliyi verilmişdir. Belə bir cədvələ kimya dərsliklərində, istinad materiallarında və internetdə rast gəlmək olar. - Burada əla bir elektronegativlik cədvəli tapa bilərsiniz. Qeyd edək ki, ən çox yayılmış olan Pauling elektroneqativlik şkalasından istifadə edir. Bununla birlikdə, elektronegativliyi hesablamağın başqa yolları var, bunlardan biri aşağıda müzakirə ediləcəkdir.
 4 Elektronatiklik meylləri. Əlinizdə bir elektrotexniki cədvəliniz yoxdursa, bir elementin dövri cədvəldəki mövqeyinə görə elektromobilliyini qiymətləndirə bilərsiniz.
4 Elektronatiklik meylləri. Əlinizdə bir elektrotexniki cədvəliniz yoxdursa, bir elementin dövri cədvəldəki mövqeyinə görə elektromobilliyini qiymətləndirə bilərsiniz. - Necə sağa element yerləşir, daha çox atomunun elektronegativliyi.
- Necə daha yüksək element yerləşir, daha çox atomunun elektronegativliyi.
- Beləliklə, dövri cədvəlin yuxarı sağ küncündə yerləşən elementlərin atomları ən yüksək elektrotexniki xüsusiyyətlərə, aşağı sol küncdə yerləşən elementlərin atomları isə ən aşağıya malikdir.
- NaCl nümunəmizdə xlorun natriumdan daha yüksək bir elektronegativliyə malik olduğunu söyləyə bilərik, çünki xlor natriumun sağında yerləşir.
Metod 2 /3: Elektronqativliyə görə bağ növünün təyin edilməsi
 1 Aralarındakı bağın xüsusiyyətlərini başa düşmək üçün iki atomun elektromobilliyi arasındakı fərqi hesablayın. Bunu etmək üçün, daha kiçik olan elektronegativliyi böyükdən çıxarın.
1 Aralarındakı bağın xüsusiyyətlərini başa düşmək üçün iki atomun elektromobilliyi arasındakı fərqi hesablayın. Bunu etmək üçün, daha kiçik olan elektronegativliyi böyükdən çıxarın. - Məsələn, HF molekulunu nəzərdən keçirək. Hidrogenin (2.1) elektromeqativliyini florun (4.0) elektroneqativliyindən çıxarın: 4.0 - 2.1 = 1,9.
 2 Fərq 0,5-dən azdırsa, bağ kovalent qeyri-qütbdür, elektronlar demək olar ki, eyni qüvvə ilə cəlb olunur. Bu cür bağlar iki eyni atom arasında əmələ gəlir. Qütb olmayan əlaqələrin kəsilməsi ümumiyyətlə çox çətindir. Bunun səbəbi, atomların elektronlarını paylaşmasıdır ki, bu da əlaqələrini sabit edir. Onu məhv etmək çox enerji tələb edir.
2 Fərq 0,5-dən azdırsa, bağ kovalent qeyri-qütbdür, elektronlar demək olar ki, eyni qüvvə ilə cəlb olunur. Bu cür bağlar iki eyni atom arasında əmələ gəlir. Qütb olmayan əlaqələrin kəsilməsi ümumiyyətlə çox çətindir. Bunun səbəbi, atomların elektronlarını paylaşmasıdır ki, bu da əlaqələrini sabit edir. Onu məhv etmək çox enerji tələb edir. - Məsələn, O molekulu2 bu cür əlaqə var. İki oksigen atomu eyni elektronegativliyə malik olduğundan aralarındakı fərq 0 -a bərabərdir.
 3 Fərq 0.5 - 1.6 aralığındadırsa, bağ kovalent qütbdür. Bu vəziyyətdə, iki atomdan biri elektronları daha güclü şəkildə cəlb edir və buna görə də qismən mənfi, digəri isə qismən müsbət yük alır. Bu yük dengesizliği molekulun müəyyən reaksiyalarda iştirak etməsinə imkan verir.
3 Fərq 0.5 - 1.6 aralığındadırsa, bağ kovalent qütbdür. Bu vəziyyətdə, iki atomdan biri elektronları daha güclü şəkildə cəlb edir və buna görə də qismən mənfi, digəri isə qismən müsbət yük alır. Bu yük dengesizliği molekulun müəyyən reaksiyalarda iştirak etməsinə imkan verir. - Məsələn, H molekulu2O (su) bu tip bir bağa malikdir. O atomu iki H atomundan daha çox elektronegativdir, buna görə oksigen elektronları daha güclü cəlb edir və qismən mənfi yük, hidrogen isə qismən müsbət yük alır.
 4 Əgər fərq 2.0 -dən çox olarsa, bağ ionikdir. Bu, ümumi elektron cütünün əsasən mənfi yük alan, daha yüksək elektronegativliyə malik bir atoma keçdiyi və daha az elektronegativliyi olan bir atomun müsbət bir yük əldə etdiyi bir bağdır. Bu cür bağları olan molekullar digər atomlarla yaxşı reaksiya verir və hətta qütb atomları tərəfindən məhv edilə bilər.
4 Əgər fərq 2.0 -dən çox olarsa, bağ ionikdir. Bu, ümumi elektron cütünün əsasən mənfi yük alan, daha yüksək elektronegativliyə malik bir atoma keçdiyi və daha az elektronegativliyi olan bir atomun müsbət bir yük əldə etdiyi bir bağdır. Bu cür bağları olan molekullar digər atomlarla yaxşı reaksiya verir və hətta qütb atomları tərəfindən məhv edilə bilər. - Məsələn, NaCl (natrium xlorid) molekulu bu tip bir bağa malikdir.Xlor atomu o qədər elektronlaşdırıcıdır ki, hər iki elektronu özünə cəlb edir və mənfi yük alır, natrium atomu isə müsbət yük alır.
- NaCl, H2O (su) kimi bir qütb molekulu tərəfindən məhv edilə bilər. Su molekulunda molekulun hidrogen tərəfi müsbət, oksigen tərəfi isə mənfi olur. Duzu su ilə qarışdırsanız, su molekulları duz molekullarını parçalayaraq həll olunmasına səbəb olur.
 5 Fərq 1.6 ilə 2.0 arasındadırsa, metal olub olmadığını yoxlayın. Bir molekulda bir metal atomu varsa, bağ ionikdir. Molekulda metal atomları yoxdursa, bağ qütblü kovalentdir.
5 Fərq 1.6 ilə 2.0 arasındadırsa, metal olub olmadığını yoxlayın. Bir molekulda bir metal atomu varsa, bağ ionikdir. Molekulda metal atomları yoxdursa, bağ qütblü kovalentdir. - Metallar dövri cədvəlin solunda və mərkəzində yerləşir. Bu cədvəldə metallar vurğulanmışdır.
- HF nümunəmizdə elektronegativlik arasındakı fərq bu aralığa düşür. H və F metal olmadığından, bağ qütb kovalent.
Metod 3 /3: Mulliken Elektroneqativliyinin Hesablanması
 1 Bir atomun ilk ionlaşma enerjisini tapın. Mulliken elektronegativlik şkalası yuxarıda göstərilən Pauling miqyasından bir qədər fərqlidir. İlk ionlaşma enerjisi bir atomu bir elektrondan çıxarmaq üçün lazımdır.
1 Bir atomun ilk ionlaşma enerjisini tapın. Mulliken elektronegativlik şkalası yuxarıda göstərilən Pauling miqyasından bir qədər fərqlidir. İlk ionlaşma enerjisi bir atomu bir elektrondan çıxarmaq üçün lazımdır. - Bu enerjinin mənasını kimya istinad kitablarında və ya şəbəkədə tapa bilərsiniz, məsələn, burada.
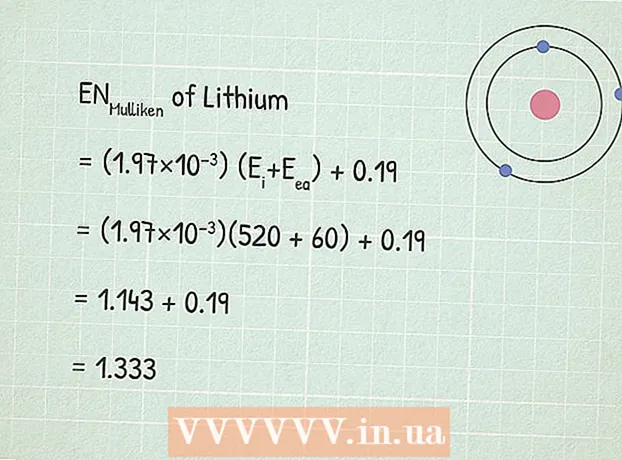
- Misal olaraq, litiumun (Li) elektroneqativliyini tapaq. İlk ionlaşma enerjisidir 520 kJ / mol.
 2 Bir elektronun yaxınlıq enerjisini tapın. Bu, bir elektronun bir atoma bağlanması zamanı ayrılan enerjidir. Bu enerjinin mənasını kimya istinad kitablarında və ya şəbəkədə tapa bilərsiniz, məsələn, burada.
2 Bir elektronun yaxınlıq enerjisini tapın. Bu, bir elektronun bir atoma bağlanması zamanı ayrılan enerjidir. Bu enerjinin mənasını kimya istinad kitablarında və ya şəbəkədə tapa bilərsiniz, məsələn, burada. - Lityumun elektron yaxınlıq enerjisi 60 kJ / mol.
 3 Mullikenin elektromeqativlik tənliyindən istifadə edin:RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19.
3 Mullikenin elektromeqativlik tənliyindən istifadə edin:RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19. - Bizim nümunədə:
- RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- Bizim nümunədə:
İpuçları
- Pauling və Mulliken tərəzilərinə əlavə olaraq, Allred-Rochow, Sanderson, Allen görə elektronegativlik tərəziləri var. Hamısının elektroneqativliyi hesablamaq üçün öz düsturları var (bəziləri olduqca mürəkkəbdir).
- Elektronegativliyin ölçü vahidi yoxdur.



